癌基因和抑癌基因是我们生物医学领域耳熟能详的名词,癌基因的高表达或获得性突变以及抑癌基因的低表达或缺失性突变被认为是肿瘤发生的最重要的原因。抑癌基因一个显著的特征是在肿瘤中低表达。究竟是因为高甲基化导致抑癌基因的表达,还是因为miRNA的调控导致抑癌基因的低表达。
当大部分科学家专注于miRNA的负向调控作用研究的时候,近10年来复旦大学于文强课题组专注于细胞核内miRNA的激活功能研究,开启miRNA全新的研究方向,提出NamiRNA即细胞核内miRNA激活(Nuclear Activating miRNA)新概念。
近日,于文强课题组联合北京中科院生态中心汪海林课题组以及复旦大学附属肿瘤医院李大强课题,揭示了肿瘤中抑癌基因沉默的新机制,为唤醒沉默的抑癌基因提供了全新的思路。
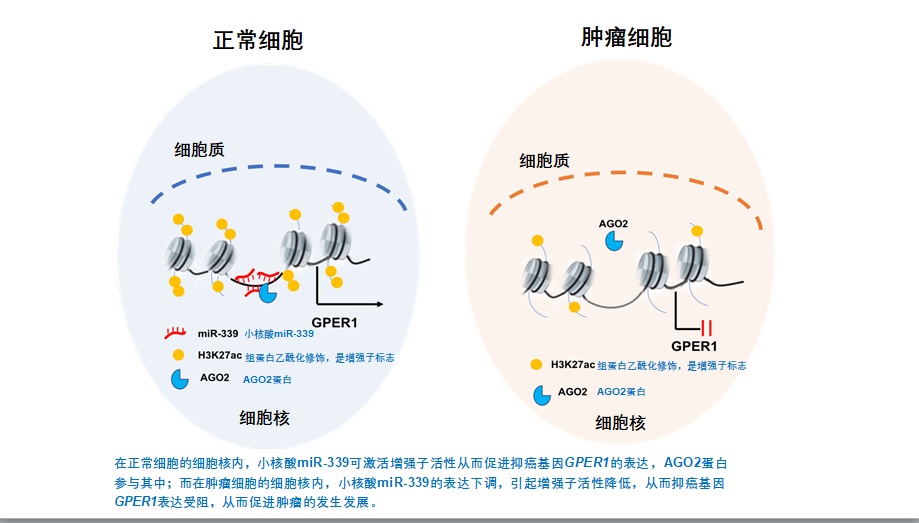
这项研究揭示了NamiRNA-增强子介导的抑癌基因的失活机制,并发现可通过NamiRNA-增强子网络可重新激活抑癌基因,提示NamiRNA-增强子可作为癌症治疗的全新靶点。
相关研究在线发表在Nucleic Acid Research杂志上。
这项研究是于文强课题有关NamiRNA第二项重要研究成果。2011年,于文强课题组开启了细胞核内miRNA的研究;6年后,发表了第一项核内miRNA研究成果,发现并定义了一类在细胞核内具有激活功能的RNA——NamiRNA(Nuclear activating miRNA),提出了NamiRNA-增强子-基因激活的新理论。
抑癌基因失活是细胞癌变过程中常发生的事件。DNA甲基化可调控基因的活性,启动子区域的高甲基化通常会抑制基因表达,这可以解释细胞癌变过程中部分抑癌基因的失活。
然而,大量的抑癌基因启动子区域并没有出现所预想的高甲基化,这些抑癌基因在肿瘤中的低表达就成了肿瘤领域的未解之谜,如何唤醒沉睡的抑癌基因更成了肿瘤研究领域可望而不可及的梦想。于是,近年来,研究者把目光投向了miRNA。
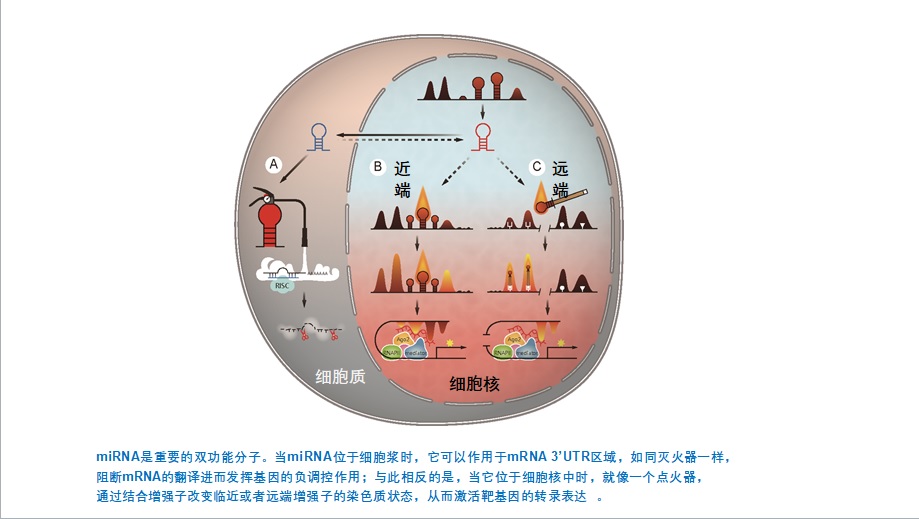
miRNA作为一种长度为18~23个核苷酸的非编码小RNA,通常被认为在细胞质中通过结合靶基因的3’-UTR降解mRNA或抑制翻译从而发挥负向调控作用。随着miRNA 研究的不断深入和深度测序技术的发展,越来越多的证据表明,miRNA 不仅可定位于细胞质,而且也存在于其他细胞器中,miRNA的不同细胞定位影响miRNA的功能。
于文强课题组在前期工作中对ENCODE数据库中7种不同细胞系1594条miRNA前体进行系统分析,发现300多条miRNA前体在基因组中的位置与增强子高度重叠,这些miRNA包括hsa-miR-24、hsa-miR-3179等;miR-3179被证实能激活邻位基因ABCC6 和 PKD1P1,miR-24-1能激活靶基因FBP1和FANCC的表达。这类miRNA定位于细胞核中并且通过靶向增强子进而激活临近或远端基因,这类细胞核内具有激活功能的miRNA定义为NamiRNA。
在这项研究中,研究者以乳腺癌作为研究对象。乳腺癌是全球发病率最高的癌症,也位列我国女性恶性肿瘤发病首位。三阴性乳腺癌(Triple-negative breast cancer,TNBC)具有高侵袭性、易转移的特点,目前尚无有效治疗手段,因此寻找新的靶点和有效治疗药物迫在眉睫。
结合NamiRNA-增强子-基因激活通路的研究以及乳腺癌中增强子的异常,研究者推测乳腺癌中可能存在大量低表达的NamiRNA,进而通过NamiRNA-增强子通路,丧失了对抑癌基因的激活作用,最终导致了抑癌基因的低表达。
为了验证这一假设,研究者在乳腺癌中低表达的NamiRNA筛选候选基因,通过mRNA-seq分析以及绝对定量PCR实验验证,最终筛选出在乳腺癌中低表达的miR-339和靶向激活的抑癌基因GPER1作为研究对象。
最终研究结果发现,乳腺癌中抑癌基因GPER1低表达与miR-339低表达有关,细胞行为学实验及动物实验结果均表明,过表达miR-339后可再激活抑癌基因GPER1进而抑制乳腺癌细胞的生长与增殖,这提示miR-339可为乳腺癌尤其是三阴性乳腺癌提供潜在的治疗靶点和策略。
在过去的10多年里,于文强实验室先后有10余人投入NamiRNA研究中,由最初的假说到实验验证,涉及NamiRNA作用机制、重要表观遗传现象的另类解释、疾病治疗新策略、重要传染性疾病新的预防方案等,希望不久的未来,通过对NamiRNA的调控,激活沉默的抑癌基因,为肿瘤治疗提供新的有力工具。
作者:秦领
编辑:姜澎
责任编辑:樊丽萍
图片来源:课题组提供
*文汇独家稿件,转载请注明出处。
